Vaccine Covid-19 “make in Vietnam”: Không thể thiếu đầu tư của Nhà nước
- Thứ bảy - 03/04/2021 22:12
- |In ra
- |Đóng cửa sổ này
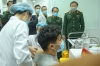

Nanogen và Học viện quân y triển khai thử nghiệm lâm sàng giai đoạn 1 vào giữa tháng 12/2020. Dự kiến đến tháng 5/2021, Nanogen sẽ hoàn thành thử nghiệm lâm sàng giai đoạn 2.
Những hỗ trợ mở đường
Dĩ nhiên, nỗ lực từ phía chính phủ từ trước đến nay không phải là không đáng kể. Ngay từ thời kì đầu dịch bùng phát, Bộ Y tế đã xác định “với bệnh truyền nhiễm lây lan nhanh, mạnh như thế này về lâu dài phải có vaccine thì cuộc sống mới nhanh ổn định và trở về bình thường”, theo lời anh Hoàng Hoa Sơn - Phó trưởng phòng Quản lý KHCN, Cục Khoa học Công nghệ và Đào tạo của Bộ Y tế. Từ giữa năm 2020, khi bốn nhà sản xuất vẫn đang ở giai đoạn nghiên cứu vaccine Covid-19 trong phòng thí nghiệm, Bộ Y tế đã tổ chức hội thảo gặp gỡ, thậm chí chủ động tổ chức các đoàn công tác (bao gồm lãnh đạo Bộ Y tế, lãnh đạo các vụ, cục liên quan) xuống tận nơi để hướng dẫn họ trước các thủ tục tiếp theo về thử nghiệm lâm sàng và đăng ký lưu hành sản phẩm.
Trước khi đại dịch Covid-19 xảy ra, không ai nghĩ rằng thời gian phát triển vaccine đang từ hàng chục năm có thể rút ngắn thần tốc, chỉ còn một năm rưỡi như bây giờ. Và Việt Nam hẳn cũng ngạc nhiên với chính mình khi đã rút ngắn được quá trình thử nghiệm lâm sàng từ nhiều năm xuống chỉ còn vài tháng. Bằng chứng là Nanogen bước vào thử nghiệm lâm sàng từ 17/12 năm 2020 và hiện nay đã tiêm xong mũi đầu tiên cho 560 người ở giai đoạn hai. Dự kiện công ty này có thể bước vào giai đoạn ba vào tháng năm năm nay.
Trước đây, mỗi giai đoạn thử nghiệm lâm sàng có thể kéo dài cả năm: những người tình nguyện sau khi tiêm mũi thứ nhất có thể phải chờ một tháng để đánh giá mức độ an toàn mới tiếp tục tiêm mũi thứ hai. Trong trường hợp tình nguyện viên được chia thành các nhóm với các liều tiêm khác nhau thì thời gian có thể còn lâu hơn nữa vì phải đánh giá xong nhóm này mới chuyển sang tiêm nhóm kia. Khi số lượng người tiêm đủ lớn, nhà sản xuất mới đánh giá tính sinh miễn dịch của vaccine trên các tình nguyện viên và sau đó lại tiếp tục theo dõi họ trong vòng từ sáu tháng đến một năm để đo lượng tồn lưu kháng thể, đánh giá mức độ bảo vệ của vaccine.
Hiện nay, các bước thử nghiệm lâm sàng đang được tiến hành theo kiểu “cuốn chiếu” và các thử nghiệm có thể được tiến hành trên nhiều nhóm cùng một lúc. Chẳng hạn, sau một tuần từ khi nhóm thứ nhất tiêm mũi đầu tiên nếu, không có phản ứng nguy hiểm thì trong thời gian chờ đợi để tiêm mũi thứ hai cho nhóm này, thực hiện tiêm mũi đầu tiên cho nhóm thứ hai. Việc đánh giá tính sinh miễn dịch cũng không chờ đợi phải đủ người mà cứ có người tiêm đủ hai mũi là làm, kể cả khi chỉ có năm người. Điều này dù mất thời gian, công sức, kinh phí hơn cho cả nhà sản xuất lẫn cơ quan quản lý, nhưng “sớm cho mình dữ liệu” dù “tất nhiên nó chỉ mang tính gợi ý thôi”, theo lời anh Sơn.
Kể cả việc phê duyệt thử nghiệm đề cương thử nghiệm lâm sàng cũng được tiến hành một cách nhanh chóng. Trước kia, đề cương này phải được hội đồng đạo đức của đơn vị sản xuất phê duyệt rồi mới trình lên hội đồng đạo đức quốc gia. Giờ đây, hai hội đồng này sẽ cùng họp và cùng phê duyệt một lúc. Hơn nữa, không đòi hỏi đề cương phải hoàn thiện tất cả rồi mới phê duyệt mà thậm chí là được phần nào phê duyệt và thực hiện ngay phần đó. Chẳng hạn như Nanogen đã được hướng dẫn để được phê duyệt ngay việc thử nghiệm lâm sàng giai đoạn một chỉ trong vòng chưa đầy một tuần kể từ lúc nộp hồ sơ (các giai thử nghiệp lâm sàng sau sẽ tiếp tục được hoàn thiện và phê duyệt sau đó).
Đơn giản hóa thủ tục hành chính, mà cụ thể ở đây là thủ tục để thử nghiệm lâm sàng và tiếp theo là đăng ký lưu hành vaccine, là một nỗ lực rất lớn của Bộ Y tế, nhất là khi hệ thống hành chính của Việt Nam vốn thiếu linh hoạt và chưa từng có kinh nghiệm hành động trong tình huống cấp bách. Nhưng đó cũng là tất cả những gì chính phủ có thể làm.
Anh Sơn chia sẻ với phóng viên Tia Sáng rằng, muốn đi từ điểm A đến điểm B nhanh hơn, thì phải có một phương tiện tốt hơn và con đường phải thênh thang hơn. Nhưng có lẽ nhà nước có thể chỉ giúp mở rộng con đường một chút, còn để nâng cấp phương tiện, mà ở đây là nguồn lực khổng lồ cho thử nghiệm lâm sàng ở giai đoạn cuối và tăng quy mô nhà xưởng để cung cấp đủ vaccine cho dân số sẽ đặt nặng lên vai doanh nghiệp.

Chiến dịch Operation Warp Speed của Hoa Kỳ do Tổng thống đứng đầu nhằm chia sẻ rủi ro với các nhà sản xuất vaccine.
Gánh nặng trên vai doanh nghiệp
Thử nghiệm lâm sàng giai đoạn ba mang tính chất sống còn đối với thành công của vaccine. Với các vaccine trước kia của Việt Nam, giai đoạn này được thực hiện theo kiểu đối đầu (head-to-head), nghĩa là so sánh hiệu quả sinh miễn dịch và tồn lưu kháng thể với một vaccine đã lưu hành lâu năm trên thị trường là đủ. Nhưng giờ đây, đó không phải là lựa chọn khả dĩ, bởi các vaccine Covid-19 đã được cấp phép vẫn còn quá sớm để khẳng định tính hiệu quả và an toàn. Cách tốt nhất vẫn là thử nghiệm lâm sàng ở giai đoạn ba trên hàng chục nghìn người, tại những nơi có số lượng ca nhiễm cộng đồng lớn để đo được hiệu lực của vaccine. Và như vậy, thì phải thực hiện ở nước ngoài. Chia sẻ với phóng viên Tia Sáng qua email, Hồ Nhân, CEO của Nanogen cho biết, họ sẽ thực hiện giai đoạn này trên ba đến 10 nghìn người trong nước và từ 10 đến 20 nghìn người ở ít nhất bốn quốc gia là Indonesia, Pakistan, Mozambique và Hungary. (Họ đang đàm phán thử nghiệm ở hai nước khác là Brazil và Argentina). Trên thế giới, chi phí cho cuộc thử nghiệm như vậy có thể lên đến hàng chục triệu USD1 (theo anh Sơn thì hiện nay ước tính chỉ khoảng 60-70 tỉ đồng Việt Nam).
Nếu vaccine thành công, thì làm thế nào để tăng quy mô sản xuất cũng là câu hỏi cần đặt ra. Hiện nay năng lực sản xuất của Nanogen là 30 triệu liều/năm và IVAC là 6 triệu liều/năm (hai đơn vị đang phát triển vaccine Covid-19 nhanh nhất ở Việt Nam hiện nay). Và như vậy là chưa đủ để đáp ứng nhu cầu vaccine trong nước “trong một sớm một chiều”.
Dù Thủ tướng nhiều lần kêu gọi “đẩy nhanh tốc độ nghiên cứu và phát triển vaccine trong nước”, trên thực tế, nhà nước chưa có cơ chế tài chính nào hỗ trợ cho việc này. Trong nhiệm vụ của Ban chỉ đạo quốc gia về phòng, chống dịch Covid-19 cũng không đề cập đến việc tập trung phát triển vaccine. Nhưng, nếu không phải nhà nước, thì ngân hàng hay quỹ đầu tư tư nhân nào sẵn sàng rót tiền cho dự án khoa học có quá nhiều rủi ro như vậy? Những kết quả của thử nghiệm lâm sàng giai đoạn hai kể cả rất hứa hẹn không thể đảm bảo thành công của thử nghiệm lâm sàng giai đoạn ba. Đó còn chưa kể trừ Nanogen ra còn IVAC, POLYVAC và VABIOTECH đều thuộc sở hữu nhà nước – điều khiến họ rất khó (nếu không muốn nói là không thể) kêu gọi đầu tư từ bên ngoài.
Nếu chính phủ vẫn áp dụng cơ chế tài trợ phổ biến cho khoa học như hiện nay, sẽ mất hàng năm để doanh nghiệp nhận được tài trợ từ ngân sách để phát triển vaccine Covid-19. Việc yêu cầu từng mục chi trong thực tế phải chính xác, y nguyên như trong đề xuất và phải tuân thủ các định mức theo hàng chục thông tư, nghị định là áp lực quá lớn đối với cả doanh nghiệp, cả các cơ quan quản lý và hội đồng phê duyệt thông qua một dự án ẩn chứa rủi ro và phải hoàn thành trong một tâm thế gấp rút trong đại dịch. Cơ quan quản lý và các hội đồng sẽ dành nhiều thời gian để nâng lên đặt xuống, dẫn đến doanh nghiệp sẽ “vật vã” giữa những cuộc họp và về sau còn phải “chật vật” trong giải trình số tiền đã tiêu. Cũng cần phải nói thêm rằng, trong thử nghiệm lâm sàng thực hiện ở nước ngoài, có thể sẽ có những hoạt động cần phải chi trả nằm ngoài những mục chi sẵn có hoặc vượt mức khung quy định của nhà nước.
Trong bốn đơn vị Nanogen, chỉ riêng POLYVAC, theo anh Sơn, là có đăng ký thực hiện một đề tài của nhà nước thông qua Bộ Khoa học và Công nghệ để phát triển vaccine Covid-19, tuy nhiên hiện nay vẫn chưa nhận được kinh phí. IVAC, VABIOTECH cho đến hiện nay đều chưa dùng bất kì tài trợ nào của nhà nước để phát triển vaccine Covid-19. Nanogen sử dụng ‘tiền túi’ của mình, IVAC nhận tài trợ của tổ chức Path – một tổ chức quốc tế về sức khỏe cộng đồng có trụ sở tại Mỹ cho giai đoạn nghiên cứu phát triển và hỗ trợ của Vingroup cho quá trình thử nghiệm lâm sàng. VABIOTECH nhận tài trợ từ dự án hợp tác với Anh và Vingroup (Vingroup tài trợ 20 tỉ đồng cho mỗi đơn vị).
Nhưng ‘bỏ mặc’ các nhà sản xuất vaccine tự xoay sở vốn để bước tiếp và kì vọng Việt Nam có thể tự chủ vaccine sớm có lẽ là một điều không thực tế. Nếu nhìn vào các vaccine đã hoặc chuẩn bị được cấp phép lưu hành trên thị trường, tất cả đều có sự tài trợ nhanh chóng và kịp thời của chính phủ từ quá trình phát triển đến thử nghiệm lâm sàng, bất kể đó là hãng dược lớn như Johnson & Johnson hay là một công ty startup như Vaccitech, công ty spin-off của Đại học Oxford, đứng đằng sau thành công của vaccine Đại học Oxford/AstraZeneca hoặc công ty đang đứng ở bờ vực phá sản như Novavax. Đối với các nước bị ‘suy sụp’ vì Covid-19 như Nga và Cuba, vaccine của họ đều do nhà nước đầu tư mạnh mẽ.
Chương trình đáng kể nhất có lẽ là Operation Warp Speed (Chiến dịch siêu tốc) của Chính phủ Mỹ do Tổng thống đứng đầu nhằm thúc đẩy quá trình phát triển, sản xuất và phân phối vaccine và các biện pháp điều trị Covid-19 nhanh nhất có thể. Chương trình này dành 10 tỉ USD để tài trợ cho các nhà sản xuất vaccine. Ra đời vào tháng 3/2020 nhưng đến tháng 7 nó đã tài trợ 1.6 tỉ USD cho việc tăng quy mô sản xuất của Novavax. Ngoại trừ vaccine Pfizer/BioNTech, các vaccine đang được WHO công nhận đều thuộc Operation Warp Speed. Nhưng điều đó không có nghĩa là Pfizer/BioNTech không nhận bất cứ tài trợ nào từ chính phủ. Vaccine này nhận tài trợ của Chính phủ Đức và kể cả Chính phủ Mỹ cũng chia sẻ một phần rủi ro với công ty này bằng cách ký hợp đồng mua trước 100 triệu liều trị giá gần hai tỉ USD khi công ty này còn chưa bước vào thử nghiệm lâm sàng giai đoạn ba.
Những cơ hội bị bỏ lỡ
Từ trước đến nay, Việt Nam đã từ bỏ nhiều cơ hội để phát triển vaccine có ý nghĩa quan trọng với sức khỏe cộng đồng ra thị trường. Gần đây nhất là vaccine đại dịch H5N1 của VABIOTECH và IVAC, thậm chí đã trải qua ba giai đoạn thử nghiệm lâm sàng thành công, nhưng cuối cùng đã không được tiếp tục đầu tư để thương mại hóa và sản xuất đại trà. Trong một bài phỏng vấn của báo Nhân Dân với GS. Nguyễn Thu Vân, Chủ nhiệm Chương trình sản phẩm quốc gia vaccine sử dụng cho người, cho thấy một loạt vaccine: vaccine dại, vaccine ung thư cổ tử cung, vaccine sốt xuất huyết…đều dừng lại ở bước phòng thí nghiệm hoặc thử nghiệm lâm sàng vì không có điều kiện cơ sở vật chất hoặc kinh phí.
Đầu tư cho vaccine Covid-19 không chỉ để nâng cao năng lực nghiên cứu và sản xuất vaccine trong nước để đối phó với những đại dịch sẽ còn có thể nguy hiểm hơn trong tương lai. Mà lợi ích trước mắt là chủ động vaccine với giá thành có thể chấp nhận được, thay vì phụ thuộc vào nguồn vaccine bấp bênh và đắt đỏ từ nước ngoài. Theo nhiều nghiên cứu gần đây đã chỉ ra rằng sẽ không đủ vaccine đáp ứng cho dân số toàn cầu ít nhất là đến năm 2023. Đó còn chưa kể tới sự bất bình đẳng trong phân phối vaccine, các nước phát triển chỉ chiếm 19% dân số thế giới đã sở hữu hơn một nửa số lượng vaccine trên thị trường2.
Dịch bệnh sẽ không dễ đi qua. Trên thực tế, mới có duy nhất một dịch bệnh trong lịch sử bị tiêu diệt hoàn toàn là đậu mùa3, các dịch bệnh khác vẫn âm ỉ ở những vùng hoặc thời điểm nhất định chờ con người “thiếu cảnh giác” sẽ bùng lên (nhất là khi phong trào anti-vaxx đang như một bóng ma lan rộng ra toàn thế giới). Covid-19 được dự báo sẽ trở lại hằng năm như cúm mùa và có thể những người dễ bị tổn thương sẽ phải tiêm nhắc lại thường xuyên. Nếu quyết tâm phát triển vaccine Covid-19, Việt Nam thậm chí còn có cả cơ hội xuất khẩu.
Liệu có hi vọng gì vào vaccine ‘make in Vietnam’? Nanogen có thể có vaccine sớm. Họ đã quyết định sẽ tiếp tục đầu tư cho những giai đoạn sau mà không cần có sự hỗ trợ tài chính từ phía nhà nước. Anh Hồ Nhân chia sẻ với phóng viên Tia Sáng rằng, lí tưởng thì sau khi kết thúc thử nghiệm lâm sàng giai đoạn hai vào tháng năm, họ sẽ xin giấy phép sử dụng khẩn cấp để khi xong giai đoạn ba, sẽ tiến hành vào bốn tháng sáu, bảy, tám, chín và sản phẩm của họ sẽ được lưu hành trong tháng 10 nếu thuận lợi.
Nếu họ thành công, đó là may mắn của Việt Nam chứ không phải là vì sự đầu tư kịp thời của Nhà nước đối với ngành vaccine. □
-----
1 https://www.sofpromed.com/how-much-does-a-clinical-trial-cost/#:~:text=The%20average%20cost%20of%20phase,median%20of%20%2441%2C117%20per%20patient.
2 https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(21)00306-8/fulltext
3https://asm.org/Articles/2020/March/ 1 Disease-Eradication-What-Does-It-Take-to-Wipe-out#:~:text=To%20date%2C%20the%20World%20Health,the%20rinderpest%20virus%20(RPV).